Bestimmung des Nitratgehaltes in Würz, Bier und anderen Getränken sowie von Malz und Hopfen
Die Methode eignet sich für Würze, Bier und andere Getränke sowie für Malz und Hopfen
Der Nitratgehalt des Bieres wird im Wesentlichen vom Nitratgehalt des Brauwassers und des Hopfens (Doldenhopfen, Hopfenpulver) bestimmt. Eine Reduktion von Nitrat zu Nitrit durch die Hefe konnte in keinem Stadium des Brauprozesses nachgewiesen werden.
Nitrat wird durch reduziertes Nicotinamid-Adenin-Dinucleotidphosphat (NADPH) in Gegenwart des Enzyms Nitrat-Reductase (NR) zu Nitrit reduziert [1].
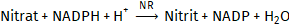
Die bei dieser Reaktion verbrauchte NADPH-Menge ist der Nitratmenge proportional. NADPH ist Messgröße und aufgrund seiner Absorption bei 334, 340 oder 365 nm zu bestimmen.
Bestimmung von Ethanol mittels Enzymatik mit zwei Enzymen (Alkoholdehydrogenase + Aldehyddehydrogenase) bei Proben mit niedrigem Ethanolgehalt.
Geeignet für Biere, alkoholfreie Biere, alkoholreduzierte Biere, Biermischgetränke, AFG, Säfte, Getränke.
Ethanol wird durch Nicotinamid-Adenin-Dinucleotid (NAD+) in Gegenwart des Enzyms Alkohol-Dehydrogenase (ADH) zu Acetaldehyd oxidiert:
\(\text{Ethanol + NAD}^+ \space ^{\underrightarrow{\text{ADH}}} \space \text{Acetaldehyd + NADH + H}^+\)
Das Gleichgewicht dieser Reaktion liegt auf der Seite von Ethanol und NAD. Durch alkalisches Milieu und durch Abfangen des gebildeten Acetaldehyds kann das Gleichgewicht auf die rechte Seite verschoben werden. Acetaldehyd wird in Gegenwart von Aldehyd-Dehydrogenase (AI-DH) quantitativ zu Essigsäure oxidiert:
\(\text{Acetaldehyd+ NAD}^+ \space ^{\underrightarrow{\text{Al-DH}}} \space \text{Essigsäure + NADH + H}^+\)
Die bei den Reaktionen gebildete NADH-Menge ist der halben Ethanolmenge äquivalent und wird aufgrund seiner Absorption bei 340 nm photometrisch bestimmt.
Spezifität der Bestimmung [1]
Der Einfluss von Aldehyden und Ketonen wird durch die Reihenfolge der Reagenzienzugabe beim Test ausgeschaltet. Methanol wird wegen ungünstiger KM-Werte (Michaelis-Menten-Konstante) der verwendeten Enzyme nicht umgesetzt.
n-Propanol und n-Butanol werden unter Testbedingungen quantitativ umgesetzt, höhere primäre Alkohole führen zu probeabhängigen Schleichreaktionen. Sekundäre, tertiäre und aromatische Alkohole reagieren nicht. Glycerin stört den Test auch bei höheren Konzentrationen nicht.
Bestimmung von Ethanol mittels Enzymatik (Alkoholdehydrogenase) bei Proben mit niedrigem Ethanolgehalt.
Geeignet für Biere, alkoholfreie Biere, alkoholreduzierte Biere, Biermischgetränke, AFG, Säfte, Getränke.
Ethanol wird durch Nicotinamid-Adenin-Dinucleotid (NAD+) in Gegenwart des Enzyms Alkohol-Dehydrogenase (ADH) zu Acetaldehyd oxidiert:
\(\text{Ethanol + NAD}^+ \space ^{\underrightarrow{\text{ADH}}} \space \text{Acetaldehyd + NADH + H}^+\)
Das Gleichgewicht dieser Reaktion liegt auf der Seite von Ethanol und NAD+. Durch alkalisches Milieu und durch Abfangen des gebildeten Acetaldehyds kann das Gleichgewicht auf die rechte Seite verschoben werden.
Die bei den Reaktionen gebildete NADH+H+-Menge ist der Ethanolmenge äquivalent und wird aufgrund seiner Absorption bei 340 nm photometrisch bestimmt.
Spezifität der Bestimmung [1]
Der Einfluss von Aldehyden und Ketonen wird durch die Reihenfolge der Reagenzienzugabe beim Test ausgeschaltet. Methanol wird wegen ungünstiger KM-Werte (Michaelis-Menten-Konstante) der verwendeten Enzyme nicht umgesetzt.
Die eingesetzte Alkohol-Dehydrogenase oxidiert primäre Alkohole. Die Wiederfindung von Ethanol liegt bei ca. 100 %, während andere primäre Alkohole (n-Propanol und n-Butanol) eine niedrigere Wiederfindung zeigen. Sekundäre und tertiäre Alkohole können zu Schleich-Reaktionen führen.
Acetaldehyd interferiert nicht unter einer Konzentration von 3000 mg/l. Sulfit interferiert nicht unter einer Konzentrationen von 300 mg/l.